水質、水處理名詞解說
水質、水處理名詞的查詢請至水質、水處理名詞總彙索引一文,有索引連結本文。
註:本文含有1個有機物中文學名,以htm格式表達時成為?符號,無法正確顯示,因此將文字拆成左右兩半(酉太),括號內的兩字合併即為問號內的字。請讀者自行合併。
相關檔案:1. 腐蝕測試.SOP 2. 腐蝕試片 3. 腐蝕照片
總彙系列:1.CNS/EER/積垢/熱傳熱力綜合系列、2.CNS/EER系列/應用、3.總彙.水處理化工技術、4.總彙.水處理術語、5.EER工程.文章總彙、6.E平台-水處理技術
水處理技術系列:1.空調水質污染計算、2.EER問題與改善方法.原理、3.化工技術解說(1)、4.化工技術解說(2)、5.空調技師-水處理設計技術、6.水處理.實用技術及市場狀況
CNS系列檔案:CNS、AHRI技術、CNS、AHRI技術要點、EER節能技術90%、空調主機EER量測驗析實務技術、EER全年確效技術、冰機EER.基準值技術及運用SOP
EER與積垢浪費檔案:EER訪測.經濟部、綠基會實測、費用展開表、LCC 20年比較表、積垢與LMTD公式演算、積垢熱傳熱力分析、LMTD公式演算筆記、節能術語解釋及技能說明
工程效益系列:費用展開表、工程經濟效益評比、偷工減料、損害業主權益
EER改善成效檢驗系列:懶人包(0)、(1)、(2)、穩態EER技術(1)、(2)、(3)
成效驗析實務系列:EER驗證分析實務(1)、(2)、EER驗證分析系統畫面
趨近溫度系列:趨近溫度的謬思(1)、(2)、(3)原來一直都錯了、(4)謬思的實證
防蝕效益系列:1. 冷卻水處理腐蝕率標準、2. 水處理防蝕經濟效益技術
法令系列:1水處理採購與法令、2水處理與能源管理法、3水處理與技師法、4.EER工程帶動空調產業發展、5.ESCO產業發展的契機、6水處理與偽造文書、7承商水處理技術
業主系列:1主機EER改善.第一步、2業主進階技術、3基本功、4.CUS/EUS發包範例.解說、5業主再進階技術、6運轉EER改善專案、7精明購買家.知識經濟、8水處理送審範例解說
監造系列:搶標下.業主監造技術(1)、(2)、(3)
【大綱】 在假貨充斥空調水處理業中,新湧就是信用、專業 TOP BOTTOM
名詞查詢請至水質、水處理名詞總彙索引一文有索引連結本文。 一. 水質相關名詞 二. 水處理相關名詞 2-1. 淨水、中水(回收水)處理相關名詞 2-2. 冷卻水處理相關名詞
【本文】 在假貨充斥空調水處理業中,新湧就是信用、專業 TOP BOTTOM
30~40年來空調業界的雙重困擾之處,尤其是施工採購送審未達CNS 12575防垢成效標準卻假冒者,就是不真、就是假貨,充斥在空調水處理業中,毋庸贅述。
要言之,由M&V節能量測驗證程式518,400筆/年運轉資料庫可依序提供:EER測試(CNS 12575)取得動態EER→依水溫負載群組→取得穩態EER→依相同水溫負載及週、月、季、半年、年之時序比較分析→確定防垢成效之檢驗結果。
一. 水質相關名詞
水處理技術之基礎需要先由瞭解水質開始,藉由認識各種水質名詞用語的意義,對於以後章節才有正確、深入的瞭解。本章對於非化學相關科系背景的空調工程師而言,可作為先修課程。也可以在讀到後面章節有不瞭解的時候,回頭重新翻查增進瞭解;本文合計1+2=3章,共計18+36+33=87節名詞,請至水質、水處理名詞總彙索引一文查詢,有索引連結本文。
1. pH
表示氫離子濃度。氫離子濃度的倒數之對數以pH表示。在水溶液,經常保持水的解離處於平衡狀態。水的離子積KW,在常溫(室溫)如下列:
KW=〔H+〕〔OH-〕=10-14(mol/L)2
中性〔H+〕=〔OH-〕=10-7(mol/L)
pH=-log〔H+〕
水的pH為7時是中性,pH 7以下時是酸性,pH 7以上時是鹼性,通常淡水的pH值在6~8的範圍。地下水大多含有遊離的二氧化碳,在和大氣中的二氧化碳保持平衡狀態時,pH上昇,大多在7以上。
冷卻塔的循環水濃縮後,通常pH上昇,但在吸收空氣中的二氧化硫氣體時,二氧化硫溶解於水中生成亞硫酸,pH會降低。冷卻水系統的設備和配管材大多是鐵和銅及其合金,這些金屬通常在比中性稍偏弱鹼的區域,是安定的。通常pH 6.5~8的範圍內之水是安全區域。pH更高的水質,必須提防碳酸根的出現,注意水垢的發生。
蒸汽鍋爐水通常使用軟水為水源,其濃縮後之爐水其pH更高可達11,此時補充水的鹼度碳酸氫根離子HCO3-轉變為碳酸根離子CO3-2容易生成碳酸鈣水垢,必須予以處理,應予注意。
2. 導電度
水的導電度乃借用電化學的概念,為水中所有離子綜合導電程度的指標。導電度高的水,表示含有腐蝕或水垢生成要因的物質很多,容易發生障礙。
另一方面,導電度的倒數就是水溶液的電氣阻抗,隨著溶解在水中的離子量(溶解的鹽類之量)的增大而降低阻抗。導電度是電氣阻抗的倒數,所以阻抗的減少意即導電度的增大。水中的溶解物質,數量較少時,導電度大致也跟著比例變化。可以根據此項特性,推定出總溶解物質的概略值。水裡所含物質的組成內容物為各式各樣,所以要從導電度測定值正確地求出溶解物質的量是困難的,但是概略推定是可能的,而這種能夠簡單瞭解溶解鹽類多寡的方法,可被使用在於水質管理指標上。
關於補給水的水質基準值,根據地質因素,以及循環使用考慮濃縮倍數,大部份的日本自來水或工業用水訂在200μS/cm以下,台灣水質的天然條件遠低於日本,大多數地區在200μS/cm以上350μS/cm以下,但高雄地區卻高達700~900μS/cm,甚至鹽化現象發生時曾高達1,200μS/cm。台灣並未訂定冷卻水的水質基準值,許多人因此參考日本JRA的水質基準值,他訂定在800μS/cm以下,但在缺水的大環境下,此基準值不斷調高,對台灣大多數地區,訂在4,500μS/cm是合宜的,少數地區例如雲林六輕便訂在6,000μS/cm。當然,在豐水的季節,基準值可以調低為2,000μS/cm,甚至1,500μS/cm。導電度每提高1°C其數值大約增大2%。
鍋爐給水的導電度,為水質測定項目之一,但其數值是通過強酸性陽離子交換樹脂之後測試出來的軟水,所以不是原水,要注意。
3. 蒸發殘留物和懸浮物
蒸發殘留物就是水蒸發乾涸之後,經一定溫度乾燥之後殘留的物質,可以推定水含有全部成份的總量。蒸發殘留物有以下兩種區分。水樣經過蒸發乾涸後殘留物質,稱為全蒸發殘留物,是懸浮物和溶解固體物的綜合。懸浮物是在一定的過濾器過濾水樣,殘留在過濾器的物質,經過105°C乾燥後之物。溶解固體物是過濾之後澄清的水經過蒸發乾燥而殘留的物質。因此測定此兩種,是求得殘留物的和或差,但是,水裡所含的物質中,有的因加熱而發生變化,如:氣體、低沸點之物,也有的一加熱即分解的,如:碳酸氫鹽,有的在空氣裡容易氧化之物(如:脂肪酸),更有蒸發乾涸後含結晶水之物,如:硫酸鹽。還有氫氧化物等由溶解性成份生成沈澱。由於這些物質的測定值並非經常一定,因此,不能認為測定值是表示溶解物質的全量或懸浮物質的全量,必須由專業人員予以判讀鑑定。
4. 全硬度
硬度成分是從鈣、鎂等的氯化物、硫酸鹽、碳酸氫鹽、碳酸鹽等構成。硬度成分和pH、M鹼度、溶解鹽類、溫度相關連,為水垢的主要構成成份。雨水、河水等流經石灰岩的土質時,硬度逐漸變高。受海水侵入影響的水,硬度成份也較高。硬水當做鍋爐給水時,要先經軟化處理,才能使用。
鐵、鋁或一些陽離子也會與硬度的測試劑作用,也當作硬度成分之中,但實務上自來水中所含的濃度都相當低,不會形成水垢,一般可以不列入考慮。
5. 鹼度
這個用詞目前在環工的水處理使用上相當普遍,它利用酸滴定測試的水樣,因此之故也可以說是酸消耗量。使用甲基橙(methyl orange)混合藥劑當指示劑時,以酸標準液,滴定至終點pH 4.3所消耗的酸量,換算成每公升的毫克當量,或是換算成碳酸鈣(1毫克當量=50 mg)相當量表示之,稱為M鹼度。使用酚酉太(phenol phathalate)當指示劑時,以酸標準液,滴定至終點pH 8.3所消耗的酸量,則稱為P鹼度。
酸消耗成分中有氫氧基離子、碳酸根離子、碳酸氫根離子、以及小部分的二氧化碳。碳酸氫根離子的pH以中性區域最多,此值變大時,容易引起水垢的產生,又,硬度成份中鹼度成分占比較高時,通常的硬水軟化仍會發生問題時,可採用脫鹼軟化。
專業廠商可以從不同pH條件下的M鹼度、P鹼度的關係式,計算出水中的氫氧基離子、碳酸根離子、碳酸氫根離子各物種的濃度,並進一步估算結垢的潛力。
從碳酸鈣的蘭吉利飽和指數來看,pH 8以上時,pH 4.3的酸消耗量(M鹼度)超過100 mg CaCO3/L的水質,則容易生成以硬度成份為主體的水垢。鹼度高的水質,在開放循環系統中,亦容易從大氣溶入二氧化硫氣體或氮氧化物等的酸性物質,進行中和反應,變為腐蝕性物質。所以,測定pH值時,須加以注意。
6. 酸度
這個用詞目前在環工水處理上也相當普遍,它可以說是鹼消耗量,有全酸度和強酸酸度。強酸酸度是滴定至pH 4.3的鹼消耗量,表示游離的硫酸或鹽酸等強酸的濃度。pH 4.3以下,有鐵或鋁等的溶解離子存在時,因為它們也會與鹼反應,所以被當作強酸滴定,造成誤差。
進一步用鹼標準液滴定至pH 8.3時,在含有二氧化碳的溶液裡,完全變化成碳酸氫根離子,至此所消耗的鹼量,稱為全酸度。水裡若不存在其他的酸時,從酸度求得二氧化碳的量是可能的。冷卻塔循環水,若有二氧化硫氣體等的溶入,酸度將很高。
7. 鐵
許多地下水含有碳酸氫鐵類成分。碳酸氫鐵分解為碳酸時,變為氫氧化亞鐵,再被氧氣氧化,變為氫氧化鐵。冷卻水系統等的配管和機器等,直接使用地下水時,內部沈積的水垢成份,大多含有這種氫氧化鐵。地下水,含有碳酸氫鐵時,若存在微量的氧,鐵細菌容易繁殖,這時,鐵細菌成為配管系統或熱交換器等的阻塞原因。鐵細菌形成黏膜的地方轉變為缺氧的狀態,這時硫酸還原菌容易繁殖,成為硫化氫生成的原因,發生第2次的腐蝕。開放循環水系統吸收了二氧化硫氣體成為酸性水,由於氧化還原反應,促進鐵或銅的腐蝕。離子交換樹脂由於鐵類成分塞住細孔,喪失離子交換機能,甚至再生也無法恢復其功能,硬度將進入鍋爐內。
實務上應該減少直接使用地下水,至少必須先以錳砂或曝氣沈澱予以處理,去除鐵份降低至0.1 ppm以下,才來使用。
8. 錳
它時常和含2價的亞鐵離子共存,多呈碳酸氫鹽的形態。若不是pH 9以上時,不被溶氧氧化。它容易被氯氧化為二氧化錳,它亦由於鐵細菌而氧化,此時產生的能量,容易造成繁殖產生黏膜。二氧化錳的水垢,形成泥狀沉澱物為配管阻塞的原因。錳離子在深井水或湖底部的水層裡,可以發現。
9. 鋁
在大自然裡,酸性土壤地帶的水裡含有之,但是通常並不多。工業用水的濁度或色度成份之去除,要添加鋁鹽實施凝集沈澱處理。運用此種處理,pH或攪伴條件不適當時,多量的鋁鹽殘存在處理水中,析出氫氧化鋁沉澱,將引起意想不到的障礙,要特別注意。離子交換樹脂由於氫氧化鋁塞住細孔,喪失離子交換機能,鋁將直接進入鍋爐內。
10. 矽土
此為河川水及地下水含有的成份,從天然的岩石及砂裡溶解出來,特別是火山灰地帶的水,含有40~100 mg/L SiO2,蛇紋岩地帶及石灰岩地帶的水,含有數 mg/L。矽土亦是形成水垢的主要成份,矽土的水垢非常硬,除去很困難,必須特別注意控制水質在限制值以下。
11. 氯離子
氯離子在河川水或地下水裡都含之,通常在50 mg/L以下。受海水入侵的影響時,濃度可達數百~數千 mg/L。這離子在濃縮時不會變化,所以在求循環水的濃縮倍數時,是最具有信賴性的指標。濃度200 mg/L以上時,成為腐蝕原因,是表現水的腐蝕性的重要因子。
12. 酸根離子
和氯同量或較少量存在於一般天然的水裡,自來水中因為沈澱處理,硫酸鋁被當作凝集劑來使用時,硫酸根離子就會增加。因此,一般的自來水中它的濃度較氯離子高,約達30~50 ppm。在受到海水的影響時,有較多量存在。在大氣中含有二氧化硫氣體的冷卻塔裡,循環水裡也有較高的溶解量。
它成為腐蝕原因的濃度也是200 mg/L以上。它容易被厭氣性的硫酸還原菌,還原為硫化氫。硫化氫或亞硫酸和溶存氧反應後,變為硫酸根離子。所以硫酸根離子依不同條件而變化,作為濃縮倍數等的指標,並不像氯離子那樣具有信賴性。
13. 硫化物
在含有溶存氧的水裡大半檢查不出它來,但在還原性的大氣中多含有之。使用含硫化氫或硫化物的水,鐵或鋼製器具及黃銅等都會腐蝕,要注意。特別是在溫泉地區使用地下水或使用停滯的水域污染水的系統,因為水中硫酸還原菌於夏季對硫酸根離子產生還原作用,成為含有多量硫化氫的水,此時要特別注意。萬一沒有其他水源、非使用這種水不可時,最好是花些費用,先用氯氣加以氧化及殺菌才使用。
14. 氮化合物
它的無機化合物有氨、亞硝酸、硝酸性氮。一般的水裡含微量,但在還原性的地下水裡,卻含有多量的氨。在畜產發達的地區其排放水、污水處理水等,氨濃度高的水混入其中的河川水水域或地下水中,當然含量升高很多,是污染指標之一。綠建築措施鼓勵採用回收水(中水道為日本使用名詞,台灣也逐漸普及,與回收水管路混用),必須注意氮化合物的含量。大氣中含氨時,溶入冷卻塔的循環水後,造成銅和氨起反應,成為銅管腐蝕的原因。冷卻水的場合,氨離子若在1 mg/L含量以下,是可以容許的。
15. 氧
氧在大部份的水裡溶存著。氧和金屬類的反應性很高,溫度愈高,其反應速度愈快。鍋爐給水,越高溫、高壓,溶存氧的規定條件越嚴格。在冷卻水系統等,金屬的表面若生成碳酸鈣水垢,則不會進行腐蝕。
水中含有機物作為營養源時,細菌等微生物容易繁殖,消耗溶存氧。在氧消失的水域裡,造成鐵或錳離子析出,甚至於會產生硫化氫的還原現象,使水質惡化。相對的若氧含量很充分時,則氨由於硝化細菌的作用,被氧化成硝酸。
16. 氧化碳
通常大氣中的二氧化碳濃度和水的二氧化碳濃度呈平衡狀態。二氧化碳溶解在水裡產生碳酸,且碳酸氫根離子有些部份分解為碳酸根離子和氫離子。二氧化碳溶解會降低水的pH值,加速金屬的腐蝕。鍋爐給水,若存在碳酸氫根離子或碳酸根離子,因熱而分解,產生二氧化碳,會隨蒸汽逸出及冷凝,降低冷凝回收水的pH,成為冷凝回收水管路的腐蝕原因。
17. COD(chemical oxygen demand)
此為化學需氧量之略稱,也就是水中的有機物或還原性物質的氧化過程,需要的氧化劑之量換算成氧的需求量,它是水質污染的主要指標之一。有機氮化合物和直鏈有機物等,根據有機物的種類,被氧化的方法各異,所以不能以此很精確地指出有機物的濃度。但是,COD仍是用來作為有機物污染程度的指標。
有些國家使用過錳酸鉀作為測定的氧化劑,另一種重鉻酸鉀的氧化力較強,再現性亦優,台灣則由環保署指定使用這種表示法來表示排放水的水質。前者以CODmn表示,後者以CODcr表示。
18. BOD(biochemical oxygen demand)
此為生物化學需氧量之略稱,也就是水中所含可分解的有機物,由於喜氣性細菌氧化時所消耗之含氧量稱之。有機物量以細菌的消耗氧氣量表示,作為有機物污染的指標,是一種非常被重視的水質污染指標。通常使用5天的氧消耗量的累積值,以BOD5表示。含氨的水,會因硝化細菌的作用,將亞硝酸氧化為硝酸,此硝化反應,造成BOD測定的誤差,所以對於含有機氮化合物的水,要特別注意。
排放水的生物處理,其設計主要依據BOD值,功能查核也倚賴用BOD測定。環保署訂定排放水的水質也包含此項指標。在中水道回收水的水質管理上,此指標亦是很重要的。
二. 水處理相關名詞
為了讓空調工程師易於瞭解,每一個名詞都簡短解釋之。讀者若想要有技術性的整合概念,必須結合基本的名詞概念,和本書第三篇空調水處理技術篇的技術概念,加上實務性的技術經驗,才能真正達到目的。
本節先介紹水道系統的概念,然後說明淨水處理的各種程序以及冷卻水的處理、鍋爐水的處理,最後解說污水處理。
如果以用戶為主體來區分水道系統,就容易瞭解這些區別了。冷卻水、鍋爐水或是製程用水都是用戶用水的主體,這主體的前端稱為上水道,後端排放流出者稱為下水道,使用後的水回收利用者稱為中水道。
2-1. 淨水、中水(回收水)處理相關名詞
淨水處理指空調補充水水源的處理程序,都市自來水或大社區通常會採用相關程序集中處理。在缺水時代必須考慮各種可能的水源,包括生活污水、製程污水來做回收處理。因此空調工程師有需要瞭解這些名詞、程序、流程及其意義,特別越來越多工程案導入綠建築的規範——回收水處理,這樣的趨勢已經非常明顯了。
1. 上水道
一般而言,上水道指的是自來水管線。如果自行挖井取水,曝氣沈澱過濾等流程也屬上水道。被使用為飲用水時,其水質需符合法定標準。工業用水若需淨化的前處理,則前處理也屬於上水道。
2. 工業用水道
使用在工業用之冷卻水或洗淨水等,通常需做前處理達到使用端用途的水質標準。一般工業用水不可含有懸浮固體物。
3. 中水道
內政部推動之「綠建築方案」已經明文列出回收水再利用設計,採積極鼓勵導入利用為原則。惟,必須通過目的用途的專業要求,才得利用;舉例來說:採用在空調冷卻水必須考慮結垢、腐蝕、藻菌等問題的障害,包括主機運轉電費、大樓人員健康…等水處理效益牽涉項目,再與成本合併計算CP值(成本效益比值)。
中水道系統乃大樓或社區生活雜排水經過處理之後,或廢水經過分流回收處理後,控制達一定的水質標準,可以再利用的水道系統。其水質可能含有多量的氨、磷成分,易滋生微生物粘膜,也可能有腐蝕或結垢之潛在問題,必須加以注意,使用在非飲用水或非與身體接觸的雜用水。可廣泛使用於沖洗廁所、清洗車輛、噴灑街道等等用途。
4. 下水道
都市中為了防止污染公共水域,如河流、池塘、湖泊、灌溉溝渠等的水質,或為了環境衛生的目的,在處理生活污水或工廠污水後,排放水流出來的專用水道。另有雨水下水道,乃匯集雨水於一處以達到豪大雨時能快速排水,避免積水構成水災的專用水道。
5. 吸附
吸附為一物理性作用的現象,乃物質的分子作用力使被吸附對象之物質於通過時,因物理性之作用力而被截留在吸附體上。最主要使用的材質除了活性碳之外,還可以使用各種的矽酸鹽化合物,金屬氫氧化物等。
6. 活性碳
在水處理中,活性碳主要針對餘氯及有機物的吸附處理,以去除這些污染。其吸附處理的適用例有以下數種:
I) 除去餘氯時使用之。特別是在使用含有多量的氯之水源,用離子交換樹脂處理時,為避免離子交換樹脂劣化,先以活性碳來處理。或是對於餘氯造成金屬的腐蝕之防止等都可用之。
II) 形成異臭味原因之有機物質的除去,飲料水等的處理。
III) 生物處理之排放水,中水道水之使用,BOD、COD物質之除去。
IV) 脫色,特別是含尿之生活排放水。
活性碳之吸附處理,分為使用微粉末狀活性碳吸附處理後凝集沈澱、過濾、分離之方式和使用粒狀活性碳層吸附過濾之方式二種。通常鍋爐給水的處理,使用後者。
7. 貫流點(break-through point)
應該除去之物質,從活性碳塔或離子交換樹脂塔下部開始流出預定值以上的濃度之點,稱為貫流點。此時視作活性碳或離子交換樹脂的處理能力已經達到飽和,運轉必需停止而進行再生恢復其處理能力。
8. 逆洗
被過濾的物質塞滿濾材,導致過濾層阻抗增大,過濾速度降低時,此時更改過濾的水流,以逆方向大流速來沖洗濾材,藉由使過濾層流體化的設計,來洗出阻塞的物質,回復過濾機能,這種動作稱為逆洗。此法可以併用空氣來增加流體化的效果。
9. 快速凝集沈澱裝置
凝集反應和沈澱分離二者合併處理的裝置,具有提高效率的功能,市面上有各種型式設計,最主要是在除去水中的懸浮物時使用。
10. 快速過濾
以4~10 m/小時的速度進行過濾,與緩過濾速度5~10 m/日比較,這種過濾速度極為快速,故如此稱之。
11. 微粒過濾法
在過濾原水時添加極微量的多價金屬離子之過濾法,此法利用多價金屬離子的電荷對微粒子的作用能力,讓微粒子能凝集而加速沈澱效果,藉此法能夠除去微粒子。
12. 膠體
水中的懸浮顆粒,其中有比重大於水的微細粒子,由於粒子表面電荷的互斥力使其穩定地懸浮著,不會沈降於底部,稱之為膠體。較明顯的例子就是下雨後的河水混濁,即使取出靜置數個小時仍然無法完全澄清,仍有微細粒子懸浮著。這些微細粒子就是膠體。
13. 凝集劑
為了使水中懸浮的膠體凝集、沈澱分離或過濾、浮上分離、遠心分離,可以使用凝集劑。鐵鹽或鋁鹽等是多價金屬離子的無機質凝集劑。凝集效果依據pH值與所用的凝集劑而改變,所以調整pH值極為重要。作為pH調節的助劑,鹼性劑可使用荷性鈉、碳酸鈉、消石灰等,酸性劑有鹽酸、硫酸等。金屬離子凝集劑以金屬離子加水分解聚合,在適當的pH範圍顯示極強的凝集作用。
有機質凝集劑有天然高分子和合成高分子凝集劑。凝集劑的鏈狀高分子必須是水溶性,具有水解成懸浮的本體並有強的親水基。
14. 凝集助劑
進行水的凝集處理時,添加其他的物質,使得凝集效果顯著改善,為了此種目的,水中所添加的物質,稱為凝集助劑。
15. 影響凝集處理的因子
使用無機質凝集劑時,pH對於凝集效果有很大的影響。冬季的水溫低時,水溫也有影響,因為水溫低,水的粘性阻抗變大,凝集處理變難。水的粘度,在20℃和0℃時,後者是前者的1.8倍。
攪拌條件對凝集效果的差別很大。急速攪拌的速度和時間,以及緩速攪伴的速度和時間,其間有很大的不同。
水中含有其他的物質,會阻礙凝集作用的進行。水質條件變化,共存鹽類或界面活性劑等,都成為影響因子。為了避免這些的影響,前處理或活性碳粉末的添加等,都有必要。
16. 凝集價
在水中的膠體粒子,隨著電解質的添加,使電荷中和而凝集。發生凝集所必要的電解質,其最低濃度稱為此電解質的凝集價。電荷大的電解質離子有強烈的凝集作用。對於負電荷膠體作用的是帶正電荷的陽離子電解質,對正電荷膠體則是帶負電荷的陰離子電解質。凝集作用的比較,一般來說2價離子的作用力是1價離子的20~80倍,3價離子是2價離子的10~100倍。這就是3價離子的鋁、鐵等鹽類,常當作凝集劑來使用的理由了。
而且,有機物的高分子若導入功能基(functional group),或帶有多電價的聚電解質,亦可當作凝集劑來使用。
17. 凝集效果
水的凝集處理,依據凝集劑的添加量、pH、共存離子等諸條件,凝集效果各不相同,因此有必要求得凝集效果的最適條件。凝集條件若理想的話,將生成大的綿絮狀的凝集體。
18. 使用傾斜板促進沈降
沈澱分離槽中,將傾斜板以相等間隔並列,沈降距離就是板和板間的垂直距離,粒子的沈降距離比水的深度大幅度地縮短,所以沈澱分離所需要的時間也大幅度地縮短,促進分離效果。依據在沈澱槽設置傾斜板,能計算出處理能力提高的程度,達到裝置小型化的目的。
19. 均等係數和有效粒徑
砂過濾器等設備表示濾材的粒度以有效粒徑和均等係數來表示。
有效粒徑是以濾材的重量,取其90%,比其粒徑大小,取其10%比其小,如此境界域的粒子的直徑。均等係數是濾材的40%,比其大的徑,用有效粒徑除之所得之數。緩速砂過濾,有效粒徑0.30~0.45 mm均等係數2.0以下,急速砂過濾,使用有效徑0.45~0.70 mm,均等係數1.7以下的砂。
20. 體積速度
離子交換樹脂塔等的通水速度,以m3水/m3樹脂/小時來表示該設備的體積速度。這與用塔的斷面積除流量得到m3/m2/小時的斷面積流速不同。
21. 矽土的去除
用OH型的強鹽基性離子交換樹脂,很容易除去它。但是離子狀的矽土,在鋁或鐵錳等氫氧化物沈澱時,具有共沈澱或吸附的性質。以這些金屬鹽作為凝集劑,利用凝集沈澱法或凝集過濾法亦可去除矽土。
22. 硬水
燒煮開水時,在壺底沈澱析出硬質水垢成分,而造成這種現象的水質稱為硬水。後來又發現使用肥皂時,硬水不容易起泡,使用量不得不增多。特別是一部份混入海水時,由於海水硬度相當高,此現象又更嚴重。有些地區,則依肥皂的起泡所需要量的多少,需要多量肥皂的水稱為硬水,需要極少量的稱為軟水。另一方面,洗手或洗澡後,要把殘留的肥皂、清潔劑洗淨,你會發現硬水較易,而軟水只有少量的硬度成分,原來的滑溜感覺必須花更多時間、更多水才能去除。
表示硬水的程度,使用硬度這個名詞。使肥皂不皂化之物有鈣、鎂的離子,以硬度來說,即是鈣和鎂的合計量。一般而言,鎂換算成和其相當的鈣量來表示,台灣直接使用CaCO3相當的mg/L量,或ppm as CaCO3來表示。在日本則1 mg/L的CaCO3是1度,美國也同樣,歐洲依國家各異,例如:德國使用gpg單位,1 gpg =17.1 mg/L CaCO3。
23. 離子交換樹脂
離子交換樹脂的使用非常廣泛,軟化、純水等等都可以使用。
離子交換樹脂的類別
離子交換樹脂有陽離子交換樹脂和陰離子交換樹脂二大類。陽離子交換樹脂具有吸入液相中的陽離子,放出自己的陽離子的性質。例如:鈉型數脂可以吸入鈣、鎂離子,置換出鈉離子,最後再利用再生步驟恢復該樹脂離子交換的能力。陰離子交換樹脂則具有吸入陰離子,放出自己的陰離子的性質。
陽離子交換樹脂的交換基,一般是酸性的,依據其酸性度,區別為強酸性陽離子交換樹脂和弱酸性陽離子交換樹脂。
陰離子交換樹脂的交換基,一般是鹽基性的,依據其鹽基性度,分類為強鹽基性陰離子交換樹脂和弱鹽基性陰離子交換樹脂。
強鹽基性陰離子交換樹脂,以第4級銨作為交換基,應用最廣。
弱鹽基性陰離子交換樹脂和第4級的銨比較,解離常數小很多,有利用第3級以下的胺導入交換基的數脂。
離子交換樹脂的選擇性
離子交換樹脂的選擇性,依據離子交換基的種類或架橋度而異,溶液的濃度低時,大概有以下的傾向:
陽離子交換的選擇性
Al3+>Ca2+>Mg2+,Cu2+,Mn2+>K+,NH4+>Na+>H+
但是在弱酸性陽離子交換樹脂,對於H+的選擇性最強。
陰離子交換的選擇性
OH->SO42->NO3->Cl-
在弱鹽基性樹脂對於OH-的選擇性很強,所以弱酸HCO3-或H3SiO4-大多不被吸著,但是在弱鹼,可以再生。
在弱鹽基性樹脂,I型和II型不同。
I型 -SO42->NO3->Cl->HCO3->OH->H3SiO4-
II型 SO42->NO3->Cl->OH->HCO3->H3SiO4-
離子交換樹脂每1g的交換容量,架橋度越低的,有越大的傾向。因為架橋度低的,容易膨潤,所以膨潤後的樹脂每1ml的交換容量,架橋度越低的,有越小的傾向。
架橋度低的,樹脂的網目構造大,離子可以很容易地在樹脂內擴散。因此架橋度低的樹脂,其離子交換速度大。相反地,架橋度高的,樹脂內部的離子擴散遲,離子交換速度變小。
為了吸著大的離子,樹脂的網目有加大的必要,為了這種目的,製造出來的巨大網狀構造樹脂或稱為MR樹脂,除了高分子離子除去之外,還使用在多種用途之上。
用離子交換樹脂能夠除去的,只有低分子的離子。非電解質或高分子電解質,大多不能被除去。在離子交換處理中成為問題的是水的濁度成份,如:聚合鋁離子、膠質矽土等的膠體物質。這些物質吸著在離子交換樹脂內,只吸著在擴散較慢的表面,且吸著後再生就就很困難了,造成樹脂的壽命大大地降低。若改用MR樹脂,雖然在某種程度內可以得到解決,此時,使用凝集法先除去這些物質仍較適宜。
24. 混床式離子交換法
用陽離子交換樹脂處理水時,液體變成酸性,依據選擇係數,只能在所定界限內交換離子。陰離子交換樹脂也是同樣的。但是,陽離子交換樹脂塔之隔壁,若設置陰離子交換樹脂塔,可與陽離子交換生出的H+中和。所以,重複陽離子交換和陰離子交換的過程,可以完全脫鹽。混床式就是在同一塔內陽離子交換樹脂和陰離子交換樹脂混合使用。也就是,陽離子交換塔和陰離子交換塔無限制地重複組合使用。利用混床式的離子交換法,在一個塔中,可以得到純度非常高的水。
25. 脫鹼軟化
碳酸氫鹽鹼度高的水,先經H型離子交換之後,再脫氣除去二氧化碳,等於除去碳酸氫根離子,這種軟化法稱為脫鹼軟化法。有H型離子交換-脫二碳化碳氣體-中和法。其中H型離子交換亦可以為Na,H兩型並聯法,或H,Na兩型串聯法等。另外,石灰蘇打法也是脫鹼軟化法之一種。
26. 氧化還原樹脂
若樹脂含有氧化還原系列物質代替離子交換基時,則表示出電子交換性亦即氧化還原性,如此之樹脂稱為電子交換樹脂或氧化還原樹脂,若將電子交換樹脂選用還原型,可以除去氧。再生時可使用亞硫酸鈉等還原劑。
普通的離子交換樹脂吸附了還原性的離子,呈現電子交換特性,吸附Cu2+或Ag+。另外像氫氧化亞鐵或氫氧化錳那樣易被氧化的物質,在離子交換樹脂內部沈澱時,亦可使用。
27. 離子交換性膜
具有離子交換功能之膜,有均質膜和不均質膜二種。將離子交換基植入膜本體為均質膜。將離子交換樹脂之微粉末,利用黏膠質(binder)製作成膜狀,則為不均質膜。
離子交換膜是多孔性之膜,只允許特定離子可以通過。依據電荷作用原理,陽離子交換膜只有陽離子可以通過,陰離子不能通過,相反地,陰離子交換膜也只有陰離子能通過,陽離子不能通過。離子交換膜與直流電壓合併使用的離子交換膜電透析法,可以適當地從鹽份濃度高的水得到低鹽份的水。EDI(Electrolysis Deionizer)就是利用這種原理設計成的純水製造裝置。
28. 逆滲透法
將水放入醋酸纖維素的半透膜,加上此水滲透壓以上之壓力,在膜的外面,滲透出不含鹽份等雜質的水,這種造水的方法稱為「逆滲透法」。利用此種原理,可以從鹽份濃度高的水得到鹽份濃度低的水。還有,可以當作離子交換法之前處理來使用,廉價得到脫礦水。
29. 氧化還原電位
指示出水中含有氧化還原物質其氧化力或還原力,就是氧化還原電位。利用金或白金可以自由地取得電子的特性來構成金屬電極,並將之浸在任意的試水中達到平衡之後,求得和適當的標準電極之間的電位差,可以測得試水的氧化還原電位。
30. 餘氯的去除
水中含有多量的餘氯時,味道變壞,不適合作為製冰用水。且它會造成金屬的腐蝕,和離子交換樹脂的劣化。所以必須除去餘氯,可以利用活性碳法吸附除去或添加亞硫酸鈉或亞硫酸氫鈉的還原除去法。
31. 純水製造
原水中的陽離子和H型陽離子交換樹脂的H+離子交換,陰離子和OH型陰離子交換樹脂所帶的OH-離子交換,脫鹽製造出純水。陽離子交換樹脂塔和陰離子交換樹脂塔的配列方法,有各種組合方法如:2B3T(二床三塔)、3B4T(三床四塔)等,也可用混床塔。最近,使用逆滲透膜法,預先除去大型的離子後,再配合離子交換樹脂塔脫鹽,很容易且廉價地得到純度高的純水。此外,還有蒸餾方式。蒸餾裝置和離子交換裝置的組合處理,可以得到高純度水。
32. 水質污染指標之測定項目
水質污染的一般性指標,用以下之項目。pH、濁度、透視度、懸浮物、溶存氧、COD、BOD。
33. 布多層濾材過濾
在濾布等的多孔性物質之過濾層表面,覆蓋石棉、活性碳等,防止過濾器之孔目阻塞,能提高過濾能率,此種過濾法稱為布多層濾材過濾法。這種方法並非只是機械性的過濾作用,還可以附帶吸附劑。純纖維素過濾材,在冷凝回收水過濾時,金屬的除去率很高,又用氫氧化鋁作布多層過濾材料,對於水中含油之分離很有效。
34. 精煉塔(Polisher)
通常在一系列複床式離子交換樹脂塔之最末段,加設混床式樹脂塔,藉以完全除去前段所殘留微量不純物。這種用途的混床式離子交換樹脂塔稱做精煉塔。精練塔中的離子交換樹脂通常改用核子級樹脂,較一般等級之樹脂所得到水的純度更高。
35. 生物脫氮
氮化合物和磷同樣的是植物、浮游生物繁殖的營養素,也是水稻生長的要素。要防止優養化,必須減少氮素化合物。生物脫氮是硝化細菌將氨變成硝酸後,利用硝酸呼吸的脫氮素細菌將有機物分解即是。脫氮在溶存氧少的條作下,脫氮素細菌呼吸時使用硝酸裡所含的氧,此時氮就排放到大氣中。
36. 生物除鐵
地下水含有Fe2+時,有必要先除鐵。含有鐵細菌時,有發生障礙之危險性。鐵細菌是利用Fe2+變成Fe3+之時所產生的能量,進行生物化學作用的菌體。此氧化過程,仍需要氧氣。但氧氣充分時,直接進行鐵的氧化反應,所以鐵細菌不能存在,只有氧氣較少時,才適合鐵細菌的繁殖。地下水經開放型砂濾槽,只有部分氧氣溶入,砂層上附著鐵細菌,Fe2+,Mn2+被鐵細菌氧化,被吸著在鐵細菌之菌體而除去,鐵或錳的除去率在90%以上,鐵細菌在砂層上面繁殖成毯狀,過濾阻抗增加時,取出細菌層清理,此種簡單的管理,可以充分除去鐵、錳。
2-2. 冷卻水處理相關名詞
冷卻水處理包括冰水、鍋爐水的處理,最主要的是它們共同的問題是水垢、腐蝕,其中冷卻水處理尚包含微生物以及懸浮固體物的處理。
1. 碳酸鈣平衡常數
Ca+2+CO3-2 → CaCO3(s)
Ksp:溶解度積常數constant of solubility product
碳酸鈣(方解石,25°C) Ksp:0.87×10–8
平衡常數 Ksp=aCa+2*aCO32-=4.9*10-9 (以活性度表達)
其中,aCa+2=γCa+2 * [Ca+2]
而aCa+2為鈣離子(Ca+2)的活性度,γCa+2為鈣離子的活性係數,[Ca+2] 為鈣離子的莫耳濃度。碳酸根離子(CO32-)依此類推。
2. 飽和指數
1936年Langelier提出「飽和指數」(Langelier Satuation Index)概念,做為水中碳酸鈣含量飽和程度的判斷依據。由於此名詞概念清楚、容易瞭解,此後數十年中水處理工程師習慣於使用它做為判斷的基礎。
Ca+2+2HCO3- → CaCO3+H2O+CO2
pHs=pCa+pMA+C
pH=-log〔H+〕 pCa=-log〔Ca+2〕 pMA=-log〔MA〕
Langelier 飽和指數 = pH - pHs
其中當飽和指數為正值時,則CaCO3傾向沉澱,若為負值時,則CaCO3傾向溶解。當穩定指數低於6.0,結垢傾向增加而腐蝕傾向降低,當穩定指數大於7.0,則無結垢形成,當穩定指數大於7.5或8.0時,腐蝕性增強。
飽和指數的應用
飽和指數利用化學平衡的概念協助釐清水質的水垢污染潛在能力,但在實務應用上它仍未能將化學動力學的因素列入評估的範圍內;因此應用時必須注意飽和指數只是某水質水垢污染潛力的指標,並不能由它直接斷定水處理的結果。常常因為「欲速則不達」的弔詭性,連水處理工程師應用時都會犯錯、弄不清楚,空調工程師更難弄清楚。這道理其實簡單,就是尺只能拿來量測長度或身高,如果要量測二維的面積或三維的體積,就必須考慮形狀變化,意即建立關係式,而須具備專業能力。雖然如此,它仍可以藉專業能力由另一個角度切入來應用,就是水處理技術的適用範圍以飽和指數來說明。水處理科學家利用靜態模擬試驗測試某種化學配方在上述水質條件下的分散抑垢能力,藉以敘述其水處理能力。換句話說,一般化學處理的範圍大約是飽和指數在0~1.8之間,這相當於鈣硬度500 ppm,M鹼度600 ppm,導電度1000μS/cm的水質。
表一說明飽和指數預測水質的水垢污染潛力,當飽和指數為0時,表示該水質處於平衡狀態,結垢、腐蝕都極為低微,即使沒有水處理也沒有問題;但當飽和指數為2.0時,表示該水質將會有明顯結垢現象,必須採用的水處理能力需達2.0以上才可以達到抑制效果。
表 一 Langelier 飽和指數用以預測水特性
|
Langelier飽和指數 |
水之傾向 |
|
+2.0 |
形成結垢,在實用目的上不腐蝕 |
|
+0.5 |
輕微的腐蝕及結垢 |
|
0.0 |
平衡,但可能有麻點似的腐蝕 |
|
-0.5 |
輕微腐蝕,但不結垢 |
|
-2.0 |
嚴重腐蝕 |
3. 穩定指數
飽和指數在實際應用時發現:若碳酸鈣的飽和指數相同,為了水的穩定化,必要的pH值越大,應該沈澱的鈣量就越少,這是碳酸鈣的飽和指數的缺點,所以Ryznar提倡使用新的指數來應用:
Ryznar 穩定指數=2pHs-pH
此值即為穩定指數。
表二 Ryznar穩定指數
|
Ryznar穩定指數 |
水之傾向 |
|
4.0~5.0 |
重度結垢 |
|
5.0~6.0 |
輕度結垢 |
|
6.0~7.0 |
微結垢或腐蝕 |
|
7.0~7.5 |
明顯腐蝕 |
|
7.5~9.0 |
嚴重腐蝕 |
利用上述二種指數可以預測結垢傾向,並決定水處理的方式、能力和用量(見表一、表二)。這樣,為防止腐蝕和結垢,調整水的pH和鹼度,使碳酸鈣達到飽和狀態,稱為水的穩定化。
水的傾向
水的傾向指的是水的結垢腐蝕傾向,其用意是使得水處理業者考慮提供服務時的技術適用程度;當然,另一面就是結果論的防垢防蝕成效,參見前方CNS系列、成效驗析系列、腐蝕系列。就如同貨運業者必須先估算貨物重量及體積,以便調派合適的貨車。舉例來說:貨物重量4.5噸,調派3.5噸貨車則太小,10噸貨車則太大,5噸貨車才恰當。以往30年來的空調用戶,由於水處理業者的專業度太差而被誤導(事實上,他們是“非專業廠商”,只提供「空口白話—不留證據」的解說),空調技師及承包商卻因職責所在,不得不鋌而走險,逞強、濫權的現象處處可見。本文是白紙黑字的解說,與非專業廠商的技術差異,可說是「天壤之別」。 廠商是否專業,檢驗其防垢防蝕成效之技術當作照妖鏡即可,參見前方CNS系列、成效驗析系列、腐蝕系列。
4. 濃縮倍數
此指冷卻水導電度與補充水導電度的比值,它通常亦是水處理技術的性能指標。
舉例來說,一般化學處理最大容許的冷卻水導電度通常為900~1,000μS/cm,相對於補充水導電度300μS/cm的狀況,其濃縮倍數約為3倍,亦即一般化學處理的性能指標其濃縮倍數約為3倍。另外的磁能「鈍水」處理最大容許的冷卻水導電度通常為4,000~4,500μS/cm,其濃縮倍數約為15倍,亦即磁能「鈍水」處理的性能指標其濃縮倍數約為15倍。
以濃縮倍數作為性能指標來描述水處理技術,與上述之飽和指數、穩定指數比起來,可以較為簡化、易懂,對缺乏水處理基本的化學素養之空調技師或工程師而言,能經由此一較為易懂的方式,容易分辨不同技術的性能,也可說是一大德政。
讀者欲進一步瞭解濃縮倍數的意義及應用可參考8-2節「開放循環系統冷卻水之水處理」以及10-2節「冷卻水回路的水質管理」。
5. 過飽和度
結晶程序的最基本條件,就是溶液本身需為過飽和溶液,意即溶液之濃度需大於飽和濃度,其間差距即為過飽和度(supersaturation),也是晶體成長與成核的驅動力(driving force)。最簡單的過飽和度定義如下式:
ΔC=C- Cs (2-1)
ΔC:過飽和度(supersaturation)
C:過飽和溶液的莫耳濃度
Cs:飽和溶液的莫耳濃度
若以相對值表示稱為相對過飽和度(relative supersaturation),如下式:
σ= (C- Cs) / Cs= ΔC/ Cs (2-2)
σ:相對過飽和度
6. 介穩區
Nielsen and Toft(1984)則針對微溶物系的濃度圖,將其概略分為四個區域:
(1) 未飽和區 (under-saturated zone):晶體會溶解直到飽和。
(2) 介穩區 (metastable zone):溶液已過飽和,在此區間內溶液若加入晶種,會有晶體成長及次成核發生。
(3) 異質成核區 (heterogeneous nucleation zone):在此區間內會發生異質成核與成長。
(4) 均質成核區 (homogenous nucleation):在此區內會引發均質成核。
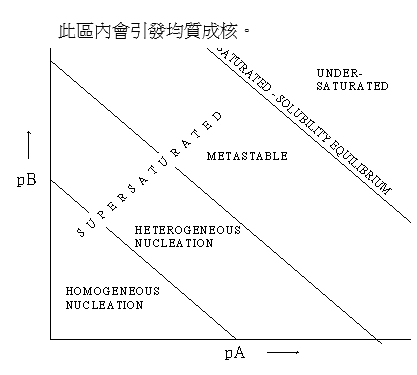
7. 水處理技術的容污力
這是節水科技的新指標,意指採用某一種特定的水處理技術,該技術所容許的導電度或是容許的濃縮倍數下最大污染值,「容許」亦即在該等污染值之下,空調主機仍能防止結垢、順利操作之意。導電度愈高的水質,其水中的硬度、鹼度等結垢的離子愈多,濃度愈高,其污染力愈強,亦即結垢潛力愈大。倘若一水處理技術容許的導電度數值愈高,亦即在該高導電度條件下,仍然可以達到防垢、防腐蝕的功效,這導電度的數值就當作該技術的容污力。
這裡有個比方,讀者較為容易瞭解。貨車的載重量愈大代表其馬力愈強。載重量10噸與載重量1噸的貨車相比,其馬力數相差極大。水處理技術的容污力代表該技術在某種污染量(導電度)的環境下,仍能發揮其處理效果,將可能的污染量「載走」(亦即達到防垢、防蝕的目的),「容許」冷卻水系統在該導電度下操作,使之不造成污染。
8. 氨和氯的反應
水中含有氨時,氯則有如下之反應:
NH3+HOCl → NH2Cl+H2O .......(2.1)
NH2Cl+HOCl → NHCl2+H2O....(2.2)
NHCl2+HOCl → NCl3+H2O .....(2.3)
氯添加量和氨的莫耳比,超越1:1附近時,氯的氧化變為很強烈,其比值在2附近時,餘氯量最低。因此,氯添加量和餘氯量並不成比例關係。此最低點出現之後,餘氯量伴隨著再添加而增加,所以此最低點稱為不連續點或稱破折點。氯的滅菌效果,在不連續點以前,是難以期待的。因此,在防止中水道的污垢生成時,要特別注意含氨量高的水。
9. 離子封鎖
金屬離子變為氫氧化物而沈澱,也有形成如碳酸鈣或硫酸鈣等難溶解性鹽類,在冷卻管或熱交換器等易生成水垢。添加與各個金屬離子,使成為安定的離子物質,謂之離子封鎖。這些添加的物質稱為金屬離子封鎖劑,或稱螯合劑。
10. 氯處理
在黏泥的防止發生或抑制,以及鐵、錳的處理上使用本法。殺菌力以次氯酸為強,次氯酸根離子為弱,前者為後者80倍的殺菌力。次氯酸和次氯酸根離子其比率隨著pH而變化。pH變低時,前者的比率增高,pH變高時,後者的比率變高,降低了殺菌力。因此,比中性附近稍低的pH最適合殺菌的目的。
11. 爐外處理
鍋爐給水水質改善的處理謂之。主要是浮游懸濁物之除去,氧、二氧化碳、硫化氫等氣體之除去,離子交換法等之軟化或脫鹽等均屬之。
12. 爐內處理
鍋爐內部因為蒸發濃縮之故,只做給水的爐外處理,是不夠的。荷性脆化、腐蝕、水垢生成等的防止,這些都須添加各種藥劑或採用物理方式,來調整爐水,稱為爐內處理。
13. 汽水共騰(priming)
爐水的一部份和蒸氣一起噴出進入蒸氣管路的現象稱汽水共騰。爐水中的成份被夾帶進入蒸氣管路的現象稱為夾帶共出(carry-over)。簡單來區分二者之不同,嚴重的現象稱為汽水共騰,輕微的現象稱為夾帶共出。
14. 水垢scale
水垢通常是由冷卻水或鍋爐水中的溶解離子(dissolved solids),因經過熱交換或溫度的改變及濃縮現象,導致低溶解度的物質沉積。這些水垢類的溶解離子通常在高溫的溶解度較低溫時為低,或是pH改變導致溶解度改變,造成水垢生成的條件成熟。
我們所熟知的鈣、鎂類沉積物就屬之。最通常的水垢成分是碳酸鈣,其餘如磷酸鈣、硫酸鈣、矽酸鈣、矽酸鎂也有時會混雜在碳酸鈣水垢之中。
15. 污垢fouling
污垢fouling是在冷凍空調主機冷凝器或鍋爐爐管表面的廣泛性混合性的沈積物,包括水垢、腐蝕生成物、微生物附著物甚至懸浮物的沈積體。
但是,一般社會大眾通常懶於區分,有時會將所有的污垢都當作水垢來看。但是水處理專業工作者必須嚴格區分,以免提供錯誤處理方式或是錯誤配方。
16. 苛性脆化
承受壓力的鋼材的結晶粒子間,由於高溫高濃度的苛性鈉侵蝕的現象謂之。高壓鍋爐的內部容易因水蒸氣氣泡的產生,發生局部性苛性鹼度在氣泡旁急遽過度濃縮的現象。防止苛性脆化的對策,可依據磷酸鈉的緩衝作用來調節pH,避免pH急遽升高,和使用其他的苛性脆化防止劑。另外,降低高壓鍋爐水的pH,使萬一失控時仍可以安全的範圍,通常為8.5以下。
17. 高溫水腐蝕
金屬的腐蝕反應速度隨著溫度的上升而有增大的傾向。在常溫不成問題的腐蝕因子,在高溫的水中也會成為重大的腐蝕原因。鍋爐用水有O2,CO2,高濃度的MgCl2,CaCl2等之氯化物,Cu,Mn鹽,H2S,SO2等之硫化物,NH3,水垢生成物等,以上物質在高溫水中都會造成腐蝕。
18. 純水腐蝕
水的解離平衡常數,在常溫附近,約10-14。溫度越高,此值就減少。因此,純水的pH隨著溫度昇高而減少,氫離子和氫氧基離子的平衡濃度增大,於是,伴著氫產生。由於氧化反應,金屬和水直接作用,其結果產生金屬的氫氧化物而腐蝕,此反應稱為純水腐蝕反應。
19. 侵蝕度
平均每一定時間的侵蝕深度。一般常用的實用單位為平均每一年的深度。腐蝕在金屬材料之全表面均一進行時,用cm / 年或mm / 年的表示方法,英、美等國使用mpy的單位,1 mpy = 0.05 mm / 年的腐蝕率。孔蝕、部份腐蝕之類只集中在局部的情形時,則用最高侵蝕度,亦即腐蝕進行最深部份之侵蝕度之值較為妥當。
20. 間隙腐蝕
水容易停滯的間隙部份,溶存氧的補給不充分,形成濃淡電池,變為陽極,促進腐蝕,此稱為間隙腐蝕。
21. 粘泥
細菌等之微生物繁殖形成之粘膜狀物體,常含有泥類物質在內,形成粘膜之微生物有細菌、絲狀菌、酵母菌等,有單獨或者複合菌種的形成。在日光照射場所,例如冷卻塔,各種藻類繁殖成膜狀。在通常含有機物之水中,若含Fe2+,鐵細菌就會繁殖,形成粘膜。此種粘膜分解之後,則生成有機物來源,又形成另一種粘膜。
22. 粘膜的除去
配管系統內粘膜生成之後,添加藥劑等之抑制劑或殺菌劑等,是不大有效果的,必須用物理性的方法除去粘膜。以大流速機械性的沖流。或添加次氯酸鈉(NaOCl 300 mg/L程度),配管內裝滿水,放置1晝夜,殺死粘膜生物後,以大流速通水,排出粘膜,將過氧化氫和次氯酸鈉併用,其效果更大。
23. 聯胺
其化學分子式為H2NNH2 。此為用來除去氧,其反應為:
H2NNH2+O2 → 2H2O+N2
反應生成物不會殘留在溶液中,所以是非常優良的脫氧劑,即使在運轉休止中,加入25%,也可防止氧的腐蝕。
24. 皮膜性胺
直鏈狀十八烷基胺在金屬表面形成吸附性防蝕膜。使用時可配製成乳化溶液,在混用蒸汽的場合,加入鍋爐給水中使用並在蒸汽管附著於其上。
25. 不純物之腐蝕
這是金屬腐蝕的原因。這些不純物有氧化性物質,例如有過氧化氫、亞硝酸鹽、硝酸鹽、Fe3+,Cu2+等,以及作為鈍態膜破壞的物質,如:Cl—,Br-,I—等。氧化性物質和氧發生同樣的局部陰極反應,參與腐蝕反應。皮膜破壞物質之Cl-離子等,在例如18-8不銹鋼,鋁等利用鈍化狀態達到防蝕目的所使用的金屬材料,破壞其鈍化狀態而引起孔蝕造成問題等。
26. 細菌腐蝕
由於硫酸鹽還原菌,把硫酸鹽轉化成硫化氫。大都市的污水流入河川或港灣水域,再被使用在冷卻水時,就發生腐蝕問題。配管內生成黏泥時,其內部就會變成厭氣狀態發生腐蝕。因此硫酸鹽還原菌等微生物並非直接腐蝕金屬,而是間接作用。此外,好氣性的鐵細菌,把亞鐵鹽轉化成氫氧化鐵而沈澱,造出鐵銹、瘤結,發生障礙。氧化鐵的沈澱皮膜在管路內形成時,皮膜內部缺乏溶存氧,形成氧濃淡電池,加強此部份的侵蝕作用。水中含硫酸鹽時,硫酸鹽還原菌存在的場合,腐蝕更為劇烈。此外,冷卻水在冷卻塔裏從大氣中吸收氨,由於硝化細菌生成硝酸,冷卻水pH降低容易發生腐蝕,須要注意。
27. 砂粒沖刷腐蝕(sand erosion)
微細砂粒等固體顆粒懸浮於水流中,隨著流速增加,對管壁的沖刷損耗也增強,這種腐蝕稱為沖刷腐蝕(erosion)。同樣地,水中的氣泡亦能造成這種沖刷腐蝕。
28. 聚合磷酸鹽
聚合磷酸鹽可與鈣、錳、鐵等多價金屬離子形成安定的錯離子,所以可當作螯合劑、軟化劑,防止水垢,防止沈澱等使用。使用上要注意的,聚合磷酸鹽溶液放置時,會起分解作用形成正磷酸鹽。此溶液含有鈣時,就生成磷酸鈣的沈澱,成為水垢,成為引起障礙之原因,且鈣離子具有促進聚合磷酸鹽分解的作用。冷卻水使用聚磷酸鹽要特別留意它的分解作用,以及隨著而引發的磷酸鈣沉澱。
29. 加氯滅菌處理
氯的氧化力強,殺菌力亦強,當作滅菌劑來添加。氯溶解在水中,生成次氯酸,和添加次氯酸是相同的作用。粘膜的除去也是靠這種強殺菌力。
30. 排放
冷卻循環水或鍋爐爐水濃度之上昇成為各種障礙之原因。令其一部份排出,補給新水,使其濃度不達到一定值以上,而實行之管理,此種濃縮水的排出,稱為排放。
31. 活性污泥法
利用懸濁性微生物,將污水中含有的有機物氧化分解除去之方法。供給必要的氧氣之同時,使懸濁微生物和污水充分接觸混合,先除去有機物後沈澱再靜置,並把微生物從水中沈澱分離出,以得到最終的處理水。伴隨著有機物的除去而增殖的微生物,在將其引出系統外時,必需和剩餘污泥處理之。
處理過的水可當作中水道回收水來回收使用。
32. 鉻酸根離子的除去
冷卻水循環系統,為了防腐蝕或抑制水垢等目的,使用含鉻酸根離子的藥劑。重鉻酸根含Cr+6離子,在排放水基準有嚴格的規定。為了達到排放水的標準,依還原法,一般是用Cr+3的氫氧化物作為去除的方法。還原劑有亞鐵鹽、亞硫酸鹽、亞硫酸氫鹽、二氧化硫氣體等。
33. 磷酸鹽的除去
為防止水域的優養化,需盡可能從排放水除去磷。在pH中性範圍,除去率最好的是使用鋁化合物,在pH 5酸性附近使用鐵化合物,除去率很高,在pH 9附近使用鈣鹽是妥當的。又磷酸根離子很能被氫氧化鋁,氫氧化鐵,碳酸鈣等吸附。另外還有生物去磷法可以使用。
如果您有其他見解或心得,歡迎您到FB陳新湧、運轉EER技術論壇、新湧產業論壇發表
如果您有任何疑問,歡迎您聯絡新湧或email告知,讓我們為您服務。









